CAR-T细胞疗法研究进展(第47期)
来源:生物谷原创 2024-10-31 09:32
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良,并使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点!
1. 从“小奇迹”到新突破!两篇Nature:2型免疫反应为CAR-T疗法的长期有效性注入新希望
doi:10.1038/s41586-024-07762-w; doi:10.1038/s41586-024-07962-4
在一项新的研究中,来自洛桑联邦理工学、耶鲁大学、宾夕法尼亚大学和克利夫兰诊所的研究人员通过研究接受CAR-T细胞疗法的患者的样本发现,与寄生虫感染有关并被认为在癌症免疫中起负面作用的2型免疫反应,实际上与癌症的长期缓解呈正相关。这可能标志着癌症治疗的范式转变。相关研究结果于2025年9月25日在线发表在Nature期刊上,论文标题为“Single-cell CAR T atlas reveals type 2 function in 8-year leukaemia remission”。
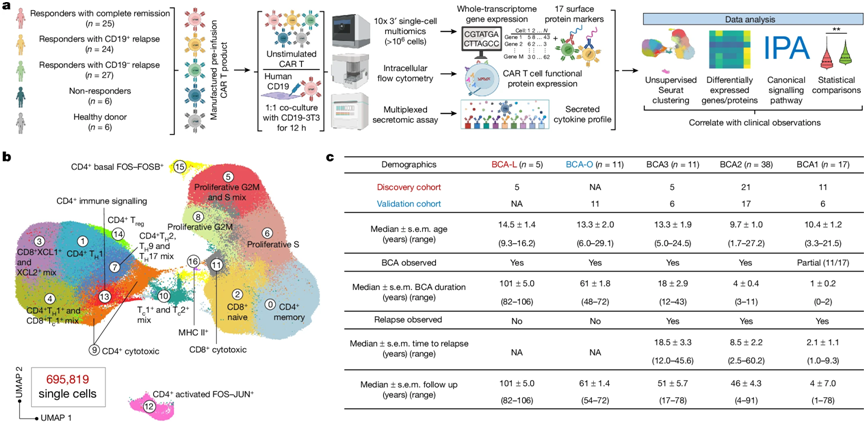
图片来自Nature, 2024, doi:10.1038/s41586-024-07762-w
在这项研究中,研究团队使用了来自82名ALL患者和6名健康对照者的近70万个CAR-T细胞,并构建了基因表达图谱来分析每个细胞。该图谱显示,长期存活的ALL患者的CAR-T细胞确实有一些特别之处:它们含有某些通常与所谓的2型免疫反应有关的蛋白,特别是细胞因子IL-4等。
1型免疫反应历来是CAR-T细胞疗法等癌症疗法的目标,与之不同的是,2型免疫反应是用来对抗寄生虫等免疫威胁的。在此之前,人们一直认为2型免疫因子对抗击癌症没有作用,甚至会促进肿瘤生长。但是,这项研究中用于构建细胞图谱的数据表明并非如此。研究团队注意到,2型免疫因子的存在与ALL八年无复发缓解之间存在统计学意义上的显著相关性。
第二项研究旨在探究2型免疫反应的机制,研究团队比较了单独使用1型CAR-T细胞免疫疗法和1型/2型联合免疫疗法对小鼠肿瘤的影响。这种联合疗法包括一种改良的、持续时间更长的IL-4细胞因子。相关研究结果于2025年9月25日在线发表在Nature期刊上,论文标题为“The type 2 cytokine Fc–IL-4 revitalizes exhausted CD8+ T cells against cancer”。
这些接受1型/2型联合疗法的小鼠不仅治愈率更高(86%),而且由于免疫记忆的作用,即使免疫系统再次受到癌细胞的侵袭,它们的存活率也会提高。对这些数据的仔细分析显示,这种改良的IL-4似乎会促进糖酵解——一种为细胞提供能量的重要代谢途径。研究团队推测,就像马拉松比赛中的碳水化合物点心一样,IL-4等2型免疫因子能为筋疲力尽的T细胞补充能量,重振它们的抗癌能力。
2. Nat Commun:揭秘CAR-T细胞疗法失败之谜!IL-4蛋白的双刃剑效应
doi:10.1038/s41467-024-51978-3
嵌合抗原受体T细胞疗法(CAR-T细胞疗法)是一种革命性的免疫疗法,但其持久反应仍然有限,部分原因是CAR-T细胞的耗竭。近日,一篇发表在国际杂志Nature Communications上题为“IL-4 drives exhaustion of CD8+ CART cells”的研究报告中,来自梅奥诊所等机构的科学家们揭示了CAR-T细胞疗法在一些患者中失败的新原因,并提出了结合抗体和基因编辑技术的新型策略,有望改善这种突破性疗法的效果。

科学家有望利用“分子剪刀”来改善CAR-T细胞疗法的疗效
CAR-T细胞疗法是一种再生免疫疗法,研究人员从患者体内收集T细胞,并在实验室中对其进行遗传学修饰,使其能够靶向肿瘤上的蛋白质。这些经过工程化改造的T细胞随后被输送回患者体内,充当“活体药物”,利用患者自身的免疫系统力量来识别并摧毁肿瘤。这种疗法在某些血液癌症中取得了显著效果,但仅在约三分之一的患者中有效。
为了寻找解决策略,研究人员分析了接受CAR-T细胞疗法治疗的患者体内的CAR-T细胞,比较了已经进入疾病缓解期的患者和治疗失败的患者的数据。他们还研究了CAR-T细胞疗法在实验室小鼠中对淋巴瘤、白血病和多发性骨髓瘤的疗效,比较了反应良好和无反应的小鼠。
研究人员发现,人类和小鼠的CAR-T细胞耗竭样本中,白介素-4(IL-4)蛋白水平显著升高。IL-4是一种能调节炎症和免疫力的特殊蛋白,通常能激活免疫系统抵御癌症。然而,研究发现,过多的IL-4蛋白会导致CAR-T细胞超载并引发耗竭。
为了验证这一发现,研究人员利用CRISPR基因编辑技术,从CAR-T细胞中移除了IL-4蛋白。结果发现,去除IL-4蛋白后,CAR-T细胞在识别和杀灭癌症方面的能力显著提升。此外,研究人员还测试了单克隆抗体阻断或中和IL-4蛋白的效果,同样发现这能使CAR-T细胞恢复活力并有效阻断癌症。
3. J Transl Med:将间质干细胞的线粒体转移给T细胞和CAR-T细胞可增强它们的抗癌功能
doi:10.1186/s12967-024-05627-4
在一项弥合了科幻小说与现实之间差距的开创性研究中,智利洛斯安第斯大学IMPACT卓越中心的Maroun Khoury团队和巴西国家癌症研究所的Martín Bonamino团队公布了一种创新方法,通过为 T 细胞和 CAR-T 细胞提供线粒体超级充能来增强它们的功能,其中T 细胞是我们身体天然的抗癌卫士,CAR-T 细胞是我们身体经过改造的抗癌卫士。相关研究结果于2024年9月27日发表在Journal of Translational Medicine期刊上,论文标题为“Survival advantage of native and engineered T cells is acquired by mitochondrial transfer from mesenchymal stem cells”。
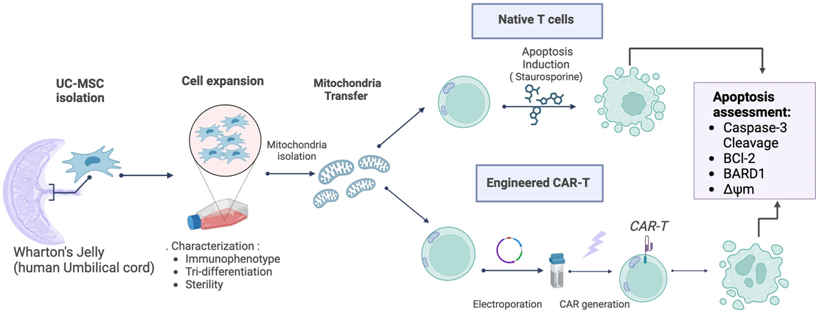
图片来自Journal of Translational Medicine, 2024, doi:10.1186/s12967-024-05627-4
具体而言,他们发现,将间质干细胞(mesenchymal stem cell, MSC)中的线粒体——细胞中产生能量的细胞器,转移到T细胞中,可以显著提高T细胞的存活率和抗癌能力。这一发现强调了这种创新的线粒体转移技术如何增强天然的T细胞和经过改造的CAR-T细胞,为癌症免疫疗法的进步铺平道路。
Khoury博士说,“这就像把一辆普通轿车变成了一辆赛车。这些‘Mito-CAR-T’细胞不仅提高了存活率,它们还具备了最佳性能,能够更有效地攻击癌细胞。”
这一突破解决了CAR-T细胞疗法的一个主要局限,即患者体内改造过的T细胞寿命很短。制造过程中的操作会造成T细胞衰竭,降低其有效性。然而,由于线粒体的增强提高了存活率,这些经过修饰的T细胞可以带来更持久、更有效的癌症治疗。
4. Nat Biotechnol:经过基因改造后表达诱饵抗性IL18的大肠杆菌可增强CAR NK 细胞的疗效
doi:10.1038/s41587-024-02418-6
近期的研究已表明,某些形式的大肠杆菌倾向于在包括肿瘤在内的身体缺氧区域定植,这表明它们可能在癌症治疗中发挥作用。
在一项新的研究中,丹娜法伯癌症研究所的Rizwan Romee博士团队和密歇根大学的Jiahe Li博士团队对源自肠道的大肠杆菌进行改造,使之在表面表达免疫激活细胞因子,目的是让这些细菌进入肿瘤并诱导有效的免疫反应。他们发现利用这种经过基因改造的细菌可强烈刺激免疫反应,增强免疫疗法的效果。相关研究结果于2024年10月4日在线发表在Nature Biotechnology期刊上,论文标题为“Non-pathogenic E. coli displaying decoy-resistant IL18 mutein boosts anti-tumor and CAR NK cell responses”。

图片来自Nature Biotechnology, 2024, doi:10.1038/s41587-024-02418-6
与免疫检查点抑制剂疗法相比,展示小鼠诱饵抗性IL18的大肠杆菌表现出更优越的抗肿瘤反应,小鼠治愈率达到50%-60%。作者还观察到这种经过基因改造的细菌治疗与免疫检查点抑制剂治疗之间的协同作用。
经治疗的肿瘤组织显示,CD8+ T细胞和NK细胞的活性和浸润增加。在小鼠体内,这种疗法还增强了靶向间皮素(mesothelin)的CAR NK 细胞的疗效,这表明这种经过基因改造的细菌为全身输注的CAR NK 细胞充当了“肿瘤 GPS”。
5. Nat Med:抗自相残杀的CD7 CAR-T细胞疗法有望治疗复发或难治性的T-ALL患者
doi:10.1038/s41591-024-03228-8
一项新的研究表明一种靶向白血病细胞中CD7蛋白的新型CAR-T细胞疗法为用尽所有标准治疗方案的T细胞急性淋巴细胞白血病(T-ALL)患者提供了一种潜在的有效治疗方法。这一发现强调了这种CAR-T细胞疗法的有效性。相关研究结果近期发表在Nature Medicine期刊上,论文标题为“Fratricide-resistant CD7-CAR T cells in T-ALL”。
该疗法由新加坡国立大学林荣禄医学院和新加坡国立大学卫生系统的研究人员自主研发,于2019年4月至2023年10月期间在新加坡国立大学医院和意大利圣母玛利亚儿童医院为17名患者进行了治疗。

图片来自Nature Medicine, 2024, doi:10.1038/s41591-024-03228-8
这17名患者的年龄从2岁到72岁不等,均患有化疗无法根治或治疗后复发的T-ALL。新加坡国立大学林荣禄医学院儿科系Dario Campana教授的实验室利用自己开发的技术,对这些患者自身的T细胞进行了重编程,使其表达靶向CD7的CAR,然后将它们重新输注到患者体内。靶向CD7的CAR能使CAR-T细胞杀死表面带有CD7蛋白的T-ALL细胞。
值得注意的是,这17名患者中有16人在一个月内获得了完全缓解,即使使用新加坡国立大学林荣禄医学院Elaine Coustan-Smith实验室开发的超灵敏流式细胞仪检测,也检测不到白血病细胞。
6. Nat Med:骨髓支持细胞因子使得AML患者对靶向CD123的CAR-T细胞产生抵抗性
doi:10.1038/s41591-024-03271-5
在抗击白血病的临床斗争中,嵌合抗原受体(CAR) T 细胞(CAR-T)的最新突破为患者和医生提供了前所未有的武器。CAR-T 细胞疗法在治疗 B 细胞恶性肿瘤方面已显示出疗效,获得了高应答率和持久缓解。然而,将这种成功转移到急性髓性白血病(AML)上却很困难。
在一项新的研究中,来自宾夕法尼亚大学的研究人员探究了源自患者的抗CD123 CAR-T细胞在治疗复发或难治性急性髓性白血病(AML)成人患者中的应用。相关研究结果于2024年9月27日在线发表在Nature Medicine期刊上,论文标题为“Cytokine-mediated CAR T therapy resistance in AML”。
图片来自Nature Medicine, 2024, doi:10.1038/s41591-024-03271-5
虽然大多数参与者都成功接受了CAR-T细胞治疗,但是研究结果突显了细胞因子释放综合征(CRS)带来的巨大挑战和相对较低的临床反应率。这表明,将CAR T细胞疗法与细胞因子信号传导抑制剂相结合可能会改善AML患者的治疗效果。
7. Blood:新研究发现CAR-T细胞治疗可能会导致年轻患者出现罕见的神经系统问题
doi:10.1182/blood.2024023933
在一项新的研究中,来自费城儿童医院的研究人员首次发现,儿童、青少年和年轻人在接受一种用于治疗 B 细胞急性淋巴细胞白血病(B-ALL)的免疫疗法——嵌合抗原受体 T 细胞(CAR-T)疗法治疗后,可能会出现非常罕见的神经系统问题:四肢轻瘫(quadriparesis)和下肢轻瘫(paraparesis)。此外,这些并发症发生时并没有出现成人常见的炎症类型。相关研究结果发表在2024年9月26日的Blood期刊上,论文标题为“Quadriparesis and paraparesis following chimeric antigen receptor T-cell therapy in children and adolescents”。
费城儿童医院癌症中心主治医师Caroline Diorio 说,“我们的研究结果表明,CAR-T细胞引起的神经系统副作用虽然罕见,但会影响从儿童到青年的各个年龄段。年轻人出现这些并发症的原因可能比通常导致成人炎症的独特 T 细胞激活和细胞因子生成过多更为复杂。炎症的缺失指向了一系列其他潜在的罪魁祸首,如代谢谱,这需要大量的额外研究来了解。”
在这项研究中,Diorio和她的团队分析了两名儿童、两名青少年和一名年轻成人,这些患者在接受靶向CD19或CD22的CAR-T细胞输注治疗B-ALL后,出现了严重的肌无力,要么是四肢肌无力(四肢瘫痪),要么是下半身肌无力(下肢轻瘫)。除一人外,其他五名患者均在研究期间死于癌症。
作者对所有五名患者都进行了详细检查,如脊髓液检测和蛋白分析,以了解患者的反应。后来,他们还对其中两名死亡患者进行了全面尸检。总体来说,他们发现大脑白质受到慢性损伤,但没有通常的炎症反应。与没有严重症状的患者相比,这些儿童体内某些炎症化学物质的水平也较低。
8. Blood:在首次真实世界研究中,CAR-T细胞疗法cilta-cel非常有效治疗复发或难治性多发性骨髓瘤
doi:10.1182/blood.2024025945
在一项报告了嵌合抗原受体(CAR)T细胞(CAR-T)疗法ciltacabtagene autoleucel(cilta-cel)治疗多发性骨髓瘤的实际疗效的首项研究中,患者的疗效和安全性与临床试验中观察到的结果相似。相关研究结果于2024年10月4日在线发表在Blood期刊上,论文标题为“Safety and Efficacy of Standard of Care Ciltacabtagene Autoleucel for Relapsed/Refractory Multiple Myeloma”。
2022年,在美国16家医疗中心接受了cilta-cel输注治疗的236名患者中,89%的患者的癌症对治疗产生了反应,70%的患者获得了完全反应,即治疗后检测不到癌症。这些数字与导致美国食品药品管理局(FDA)批准 cilta-cel 上市的2期 CARTITUDE-1临床试验的结果相当,后者的反应率为 98%,完全反应率为 83%。
作者表示,最值得注意和鼓舞人心的是,这项新研究中一半以上的患者本来没有资格参加 CARTITUDE-1。
论文通讯作者、斯坦福大学医学院副教授Surbhi Sidana 说,“尽管在现实世界中,大多数患者在表现状态、器官功能或基线血细胞计数方面并不像导致 FDA 批准(这种疗法)上市的临床试验中那样适合,但这些患者也能取得很好的疗效。我们看到了非常高的反应率,而且似乎是持久的,尽管有一半以上的患者不符合(临床试验的)资格标准。反应率和直到骨髓瘤进展或因任何原因死亡的时间都在临床试验观察到的结果范围之内。”
9. Nat Cancer:新研究发现CAR-NKT细胞比CAR-T细胞更有效治疗实体瘤
doi:10.1038/s43018-024-00830-0
在抗癌斗争中,嵌合抗原受体 T 细胞(CAR-T)疗法在治疗血癌方面取得了显著成功。然而,这种疗法对实体瘤基本无效。如今,在一项新的研究中,来自北卡罗来纳大学的研究人员发现一种利用自然杀伤T细胞(NKT)的不同免疫疗法在实体瘤临床前模型中产生了显著的抗肿瘤活性。相关研究结果于2024年10月1日在线发表在Nature Cancer期刊上,论文标题为“CAR-redirected natural killer T cells demonstrate superior antitumor activity to CAR-T cells through multimodal CD1d-dependent mechanisms”。
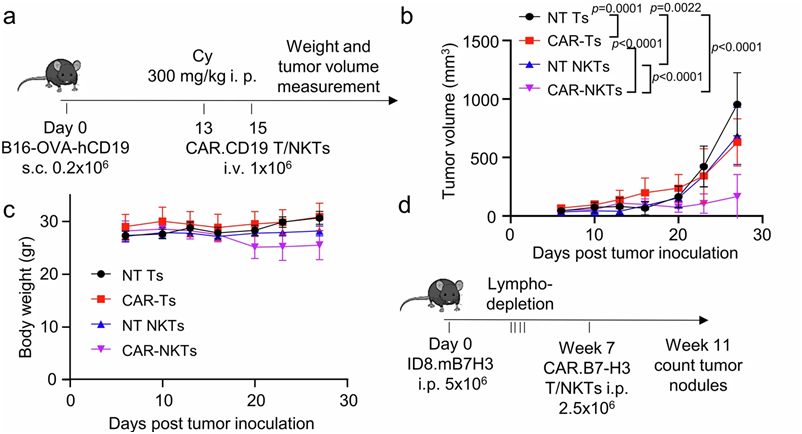
图片来自Nature Cancer, 2024, doi:10.1038/s43018-024-00830-0
北卡罗来纳大学医学院微生物学与免疫学教授Gianpietro Dotti、Dotti实验室博士后研究员Xin Zhou博士及其同事们报告,表达CAR的自然杀伤T细胞(CAR-NKT)利用一种结合肿瘤细胞直接杀伤、重编程肿瘤微环境和促进全身免疫反应的多模式方法,在肿瘤中产生了更为免疫原性的微环境。
以前的研究已表明,CAR-T 细胞在实体瘤内穿透和发挥作用的能力有限,这主要是由于肿瘤内的物理屏障和肿瘤微环境的抑制性质造成的。NKT细胞具有了对抗实体瘤的独特能力。具体来说,它们表达的T细胞受体能识别由CD1d分子呈递的糖脂抗原。
Dotti、Zhou 和他们的同事们证实CAR-NKT 细胞能有效消除肿瘤微环境中表达 CD1d 的 M2 样巨噬细胞。这些巨噬细胞会促进肿瘤生长并抑制免疫反应,因此清除它们是增强抗肿瘤免疫力的一个关键环节。通过靶向这些细胞,CAR-NKT细胞疗法能有效地将肿瘤微环境从有利于肿瘤的环境重编程为抗肿瘤环境。
他们还报告说,CAR-NKT 细胞促进了表位扩散——一个由免疫系统识别和攻击新靶点的过程,从而激活了 T 细胞反应。
Zhou说,“我们的研究结果表明,CAR-NKT细胞不仅能有效消除肿瘤微环境中表达CD1d的M2样巨噬细胞,还能刺激内源性免疫细胞。这种双重功能可以克服抑制性免疫细胞和促进持续的免疫活性,代表了在改进基于CAR的实体瘤疗法和实现长期肿瘤控制方面取得的重要进展。”
10. Cancer Immunol Res:新研究表明靶向PTPRZ1的CAR-T细胞有望治疗胶质母细胞瘤
doi:10.1158/2326-6066.CIR-23-1094
胶质母细胞瘤是最常见、侵袭性最强的原发性脑瘤,确诊后的平均生存期不到两年,目前的治疗方法对其仍然无效。近年来,免疫疗法给患者带来了新的希望,但是治疗成功率仍然相对较低。
在一项新的研究中,来自日内瓦大学和日内瓦大学医院的研究人员成功地确定了胶质母细胞瘤表面上的一种特定标志物,并且成功地开发出靶向这种标志物的CAR-T细胞来消灭它们。这些CAR-T细胞似乎能够靶向肿瘤中不携带这种标志物的病变细胞,而放过健康细胞。这一发现为开展人体临床试验迈出了第一步。相关研究结果近期发表在Cancer Immunology Research期刊上,论文标题为“PTPRZ1-targeting RNA CAR T cells exert antigen-specific and bystander antitumor activity in glioblastoma”。
作为CAR-T 细胞(嵌合抗原受体 T 细胞)方面的专家,日内瓦大学医学院医学系助理教授Denis Migliorini说,“几年来,我们一直在努力识别胶质母细胞瘤细胞表达的蛋白标志物。其中的一种标志物 PTPRZ1 尤为重要:我们能够产生靶向PTPRZ1的 CAR-T 细胞。这是 CAR-T 细胞有效对抗恶性胶质瘤的第一步。”
为了确保靶向PTPRZ1的CAR-T细胞只攻击肿瘤细胞,作者首先在体外对健康细胞和肿瘤细胞进行了测试。Migliorini说,“令我们惊讶的是,CAR-T细胞不仅不会攻击健康细胞,而且还能通过旁观者效应识别和对抗不表达 PTPRZ1 标志物的肿瘤细胞。在这种情形下,CAR-T细胞很可能能够分泌促炎分子,即使在没有原始标志物PTPRZ1的情况下,当与PTPRZ1阳性肿瘤细胞共同培养时,它们也负责消除肿瘤细胞。”(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


